Efficacy
Efficacy
LYFNUA® (gefapixant) is proven to help reduce 24-hour cough frequency and improve cough-specific quality of life1
Patients taking LYFNUA® 45 mg twice daily showed a statistically significant reduction in 24-hour cough frequency relative to placebo in two phase 3 clinical trials.1
The reduction in 24-hour cough frequency was observed by Week 4 and persisted throughout 12 and 24 weeks.1
COUGH-1: Reduction in 24-hour cough frequency at 12 weeks relative to placebo was -18.52%* (95% CI: -32.76, -1.28; p=0.036)
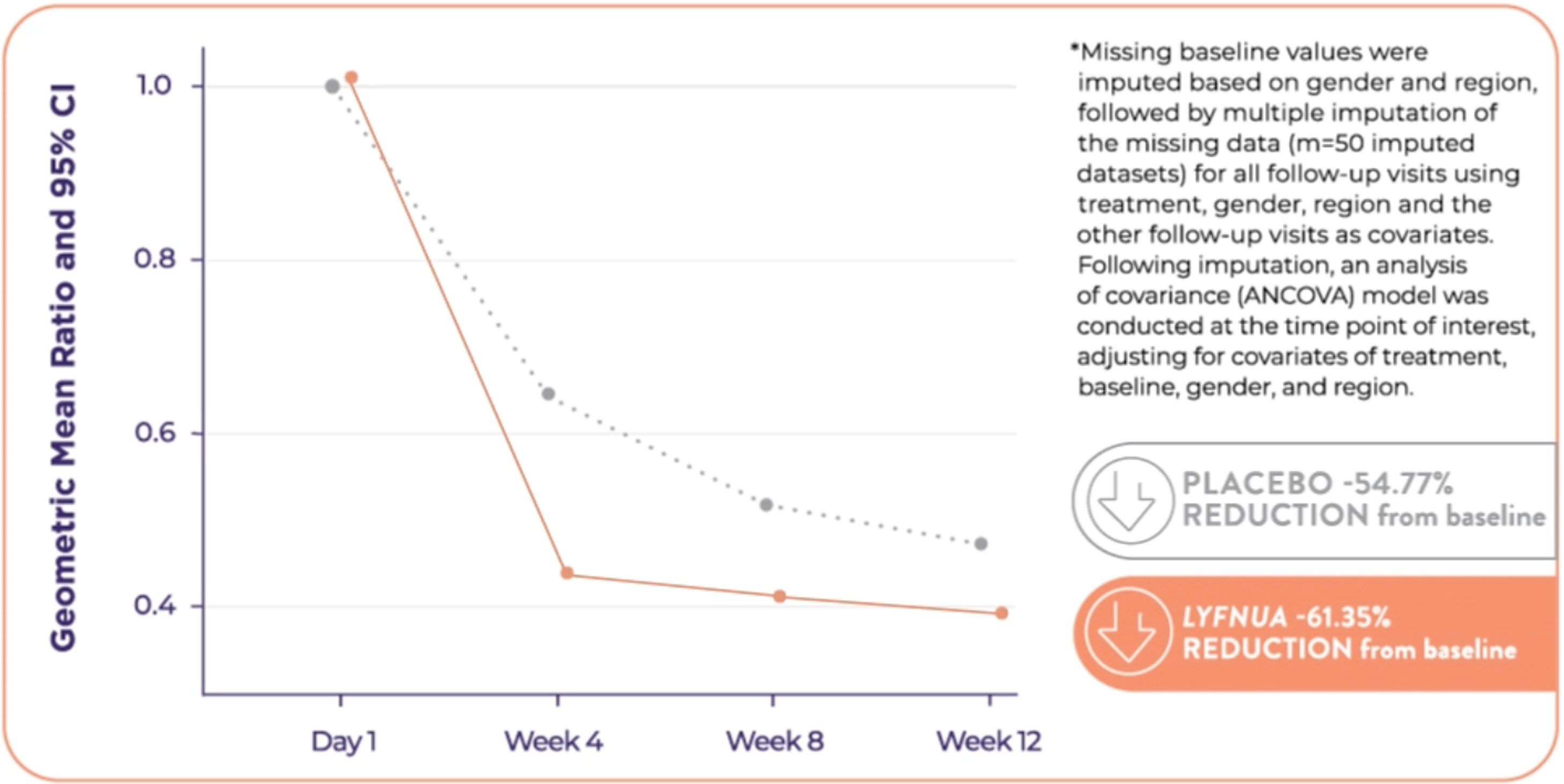
*Based on a population pharmacokinetic analysis, age, body weight, gender, ethnicity, and race do not have a clinically meaningful effect on the pharmacokinetics of LYFNUA®.
Clinical Study Design
EXPLORE THE PHASE 3 CLINICAL TRIALS
A landmark clinical program
LYFNUA® was evaluated in two phase 3 clinical trials, including extensions up to Week 521

PRIMARY OBJECTIVE:
Reduction in 24-hour cough frequency relative to placebo1

SECONDARY OBJECTIVES:
Reduction in awake cough frequency and cough-specific quality of life1

COUGH-1 and COUGH-2:
Two 52-week, multicenter, randomized, double-blind, placebo-controlled studies of adults (N=2044) with either refractory or unexplained chronic cough1,2
Patients were randomized to twice-daily doses of LYFNUA® 45 mg, 15 mg (not shown), or placebo1


Safety was evaluated in 1369 patients from COUGH-1 and COUGH-2 treated with LYFNUA® (15 mg or 45 mg twice daily) over 52 weeks.1
Patients with a range of age, cough duration, and most common comorbid conditions were enrolled in both trials1,3
Select baseline demographics1,3:

Percentage of female patients: 75%

Mean age: 58 years old (range 19 to 89)

Mean duration of chronic cough: 11 years

Percentage of paatients diagnosed with refractory chronic cough: 61.5%

Percentage of patients diagnosed with unexplained chronic cough: 38.5%

Most common comorbid conditions: asthma, GERD, and allergic rhinitis2
GERD, gastroesophageal reflux disease; refractory chronic cough, cough associated with a comorbid condition that persists despite adequate treatment of the comorbid condition; unexplained chronic cough, cough not associated with a comorbid condition despite a thorough evaluation.1
COUGH-2: Reduction in 24-hour cough frequency at 24 weeks relative to placebo was -13.29%* (95% Cl: -24.74, -0.10; p=0.048)
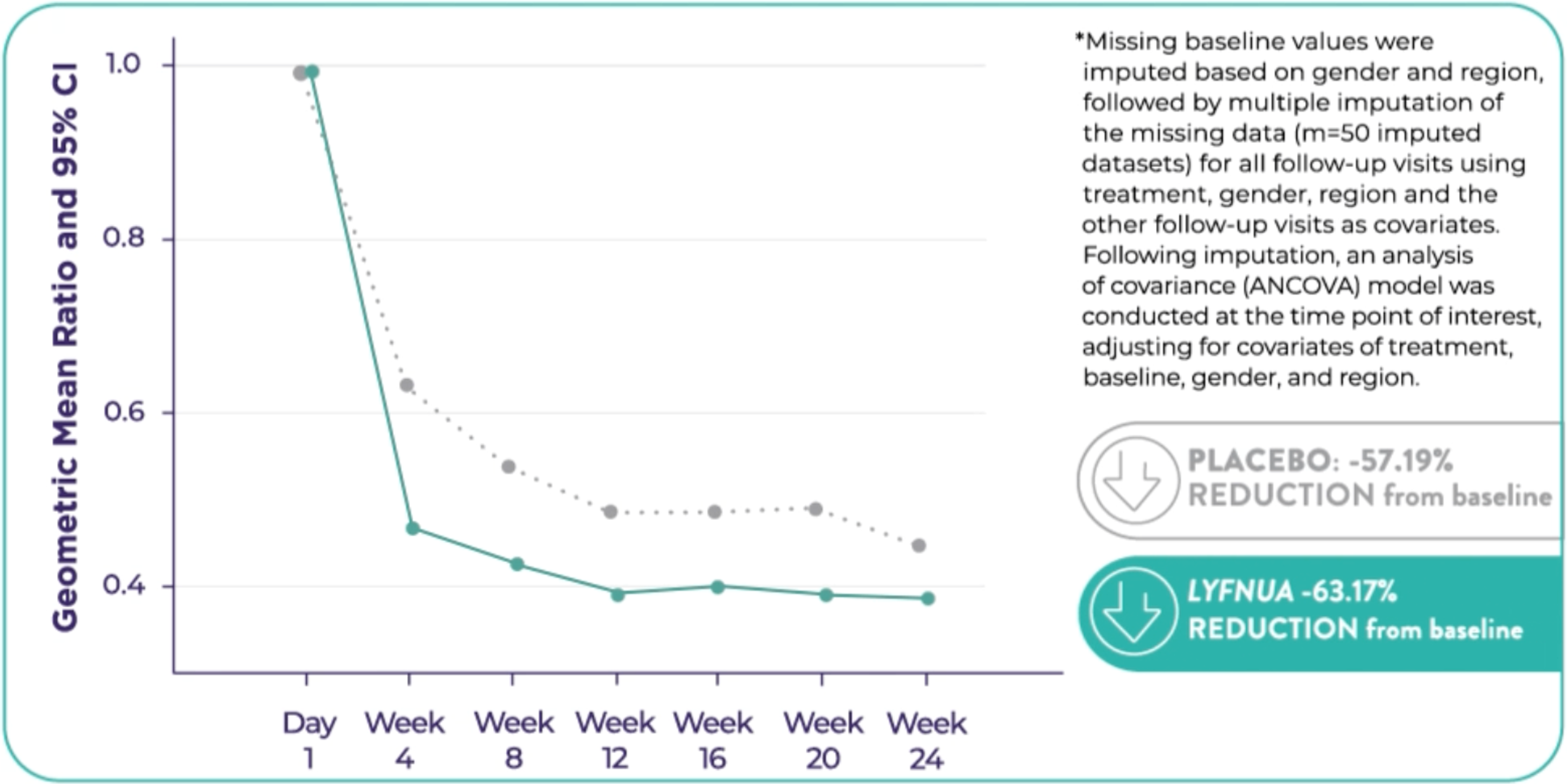
Clinical Study Design
EXPLORE THE PHASE 3 CLINICAL TRIALS
A landmark clinical program
LYFNUA® was evaluated in two phase 3 clinical trials, including extensions up to Week 521

PRIMARY OBJECTIVE:
Reduction in 24-hour cough frequency relative to placebo1

SECONDARY OBJECTIVES:
Reduction in awake cough frequency and cough-specific quality of life1

COUGH-1 and COUGH-2:
Two 52-week, multicenter, randomized, double-blind, placebo-controlled studies of adults (N=2044) with either refractory or unexplained chronic cough1,2
Patients were randomized to twice-daily doses of LYFNUA® 45 mg, 15 mg (not shown), or placebo1


Safety was evaluated in 1369 patients from COUGH-1 and COUGH-2 treated with LYFNUA® (15 mg or 45 mg twice daily) over 52 weeks.1
Patients with a range of age, cough duration, and most common comorbid conditions were enrolled in both trials1,3
Select baseline demographics1,3:

Percentage of female patients: 75%

Mean age: 58 years old (range 19 to 89)

Mean duration of chronic cough: 11 years

Percentage of patients diagnosed with refractory chronic cough: 61.5%

Percentage of patients diagnosed with unexplained chronic cough: 38.5%

Most common comorbid conditions: asthma, GERD, and allergic rhinitis2
GERD, gastroesophageal reflux disease; refractory chronic cough, cough associated with a comorbid condition that persists despite adequate treatment of the comorbid condition; unexplained chronic cough, cough not associated with a comorbid condition despite a thorough evaluation.1
LYFNUA® significantly improved cough-specific quality of life in 3 of 4 patients

*The Leicester Cough Questionnaire is a validated, multidimensional, patient-reported, health-related quality of life questionnaire commonly used in clinical studies assessing cough. It evaluates physical, social, and psychological components of cough-specific quality of life.3 A ≥1.3 point increase from baseline in LCQ total score was defined as clinically meaningful.
Clinical Study Design
EXPLORE THE PHASE 3 CLINICAL TRIALS
A landmark clinical program
LYFNUA® was evaluated in two phase 3 clinical trials, including extensions up to Week 521

PRIMARY OBJECTIVE:
Reduction in 24-hour cough frequency relative to placebo1

SECONDARY OBJECTIVES:
Reduction in awake cough frequency and cough-specific quality of life1

COUGH-1 and COUGH-2:
Two 52-week, multicenter, randomized, double-blind, placebo-controlled studies of adults (N=2044) with either refractory or unexplained chronic cough1,2
Patients were randomized to twice-daily doses of LYFNUA® 45 mg, 15 mg (not shown), or placebo1


Safety was evaluated in 1369 patients from COUGH-1 and COUGH-2 treated with LYFNUA® (15 mg or 45 mg twice daily) over 52 weeks.1
Patients with a range of age, cough duration, and most common comorbid conditions were enrolled in both trials1,3
Select baseline demographics1,3:

Percentage of female patients: 75%

Mean age: 58 years old (range 19 to 89)

Mean duration of chronic cough: 11 years

Percentage of patients diagnosed with refractory chronic cough: 61.5%

Percentage of patients diagnosed with unexplained chronic cough: 38.5%

Most common comorbid conditions: asthma, GERD, and allergic rhinitis2
GERD, gastroesophageal reflux disease; refractory chronic cough, cough associated with a comorbid condition that persists despite adequate treatment of the comorbid condition; unexplained chronic cough, cough not associated with a comorbid condition despite a thorough evaluation.1
CLICK THE FOLLOWING TO LEARN MORE
INDICATION
LYFNUA® is indicated in adults for the treatment of refractory or unexplained chronic cough (RCC).1
References:
- LYFNUA®, Summary of product characteristics
- McGarvey LP et al. Lancet. 2022;399:909-923
- Muccino DR et al. ERJ Open Res. 2020 Nov 2;6(4):00284-2020
▼Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning.
Lyfnua® (gefapixant); 45 mg filmdragerade tabletter. Övriga hostdämpande medel, R05DB29, Rx, saknar subvention, SPC 09/2023.
INDIKATIONER: LYFNUA® är indicerat för behandling av refraktär eller oförklarlig kronisk hosta hos vuxna.
DOSERING OCH ADMINISTRERING: Den rekommenderade dosen är en tablett på 45 mg två gånger dagligen oralt. Tabletterna ska sväljas hela och kan tas med eller utan föda. Patienter ska instrueras att inte bryta, krossa eller tugga tabletterna.
Hos äldre patienter bör försiktighet iakttas med initial doseringsfrekvens. Äldre patienter är mer benägna att ha nedsatt njurfunktion och risken för biverkningar av Lyfnua kan därmed vara större i denna patientgrupp.
KONTRAINDIKATIONER: Överkänslighet mot den aktiva substansen eller mot något hjälpämne.
VARNINGAR OCH FÖRSIKTIGHET: Obstruktiv sömnapné: I studier var 180 mg Lyfnua en gång dagligen, till natten, förknippat med lägre genomsnittlig syremättnad och en högre andel tid med genomsnittlig syremättnad < 90 % jämfört med placebo. För patienter med obstruktiv sömnapné bör lämplig behandling av denna övervägas innan behandling med Lyfnua påbörjas. Överkänslighet: Lyfnua bör användas med försiktighet till patienter med känd överkänslighet mot sulfonamider. Akut infektion i nedre luftvägarna: Behandling med Lyfnua ska utvärderas och individanpassas hos patienter som utvecklar en akut infektion i nedre luftvägarna. Smakrelaterade biverkningar: Smakrelaterade biverkningar var rapporterade som mycket vanliga i de kliniska studierna. Hos de flesta patienter försvann dessa biverkningar kort efter att behandlingen med Lyfnua avslutats (median 5 dagar). Hos ett fåtal patienter kvarstod smakrelaterade biverkningar mer än ett år efter avslutad behandling.
BIVERKNINGAR: De vanligaste rapporterade biverkningarna (≥ 1/10) var dysgeusi (41 %), ageusi (15 %) och hypogeusi (11 %). Andra vanliga rapporterade biverkningarna från studier med gefapixant (≥ 1/100 till < 1/10) var övre luftvägsinfektion, minskad aptit, smakstörning, yrsel, hosta, smärta i orofarynx, illamående, diarré, muntorrhet, överproduktion av saliv, övre buksmärta, dyspepsi, oral hypoestesi, oral parestesi och sömnlöshet.
INTERAKTIONER: Inga kliniskt betydelsefulla interaktioner har identifierats.Inga kliniskt betydelsefulla interaktioner har identifierats.
SÄRSKILDA PATIENTGRUPPER: Äldre: Ingen dosjustering behövs för patienter ≥ 65 år. Nedsatt njurfunktion: Ingen dosjustering behövs för patienter med lätt eller måttligt nedsatt njurfunktion. Hos patienter med svårt nedsatt njurfunktion som inte behöver dialys, ska dosen minskas till en tablett på 45 mg en gång dagligen. För patienter med njursjukdom i slutstadiet som kräver dialys finns inte tillräckliga data tillgängliga för att kunna rekommendera dosering. Nedsatt leverfunktion: Lyfnua har inte studerats hos patienter med nedsatt leverfunktion. Eftersom levermetabolism är en mindre elimineringsväg för Lyfnua rekommenderas ingen dosjustering. Pediatrisk population: Det finns ingen relevant användning av Lyfnua vid indikationen refraktär eller oförklarlig kronisk hosta hos personer yngre än 18 år.Graviditet: Som en försiktighetsåtgärd bör man undvika användning av Lyfnua under graviditet och hos fertila kvinnor som inte använder preventivmedel. Inga data finns tillgängliga från användning hos gravida kvinnor. Amning: Djurstudier tyder på att Lyfnua utsöndras i bröstmjölk. En risk för det nyfödda barnet/spädbarnet kan inte uteslutas. Beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling med Lyfnua, efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan. Fertilitet: Inga humandata finns tillgängliga om Lyfnuas effekt på fertiliteten.
För fullständig information, priser och förpackningar, se www.fass.se
SE-OGM-00008, 10/2023



